RIのキレート部位と低分子抗体との間に尿細管特異的な酵素の切断配列を付与することでRIが速やかに尿に排出される安全性の高い分子設計
Advantages
- 投与後、血液クリアランスも速く、腎臓にも滞留することなく速やかに尿中に排出される。
- 腎臓に近い標的組織の画像化も可能。
Background and Technology
同じ抗体やペプチドに異なる放射性核種(RI)で標識して、癌の画像診断と治療を行うradiotheranosticsの有用性が確かめられ、近年では血液クリアランスを改善させるために、抗体のFabフラグメントなどを用いたRI標識低分子ペプチドの開発が進められている。一方で、RI標識ペプチドは近位尿細管細胞内に取り込まれるため、腎臓に長時間滞留することで、画像診断精度の低下や腎毒性が問題となっていた。
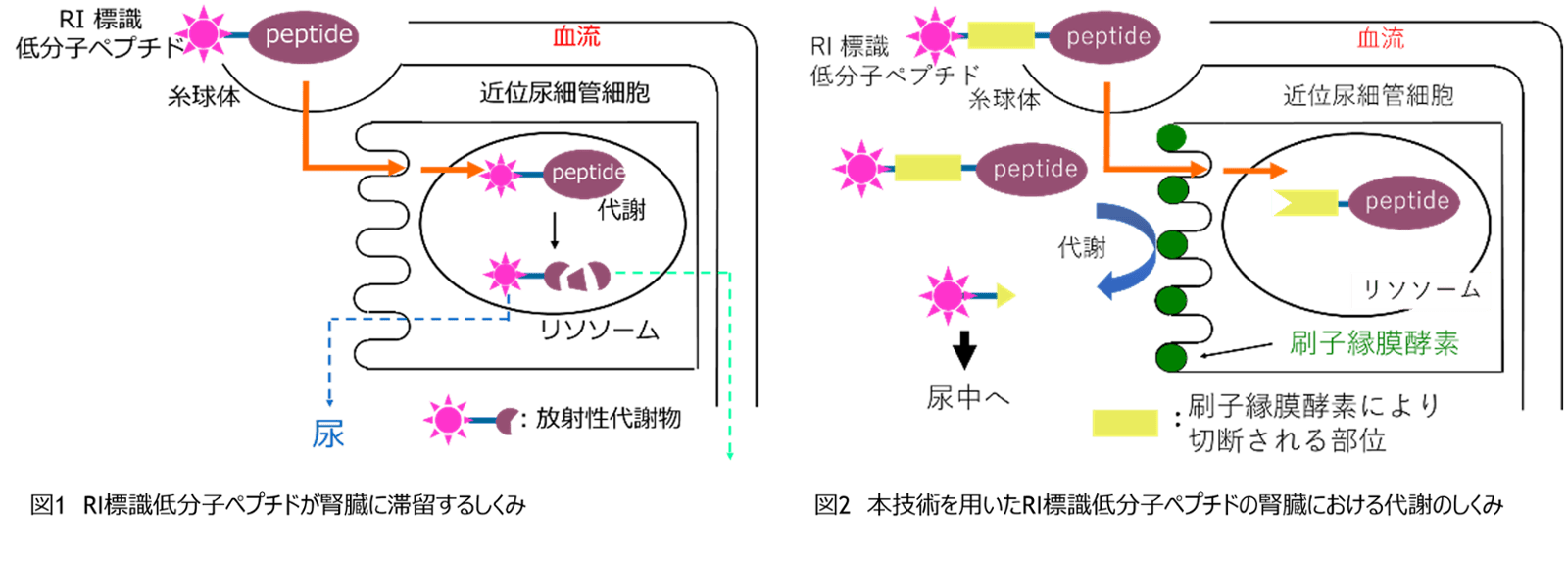
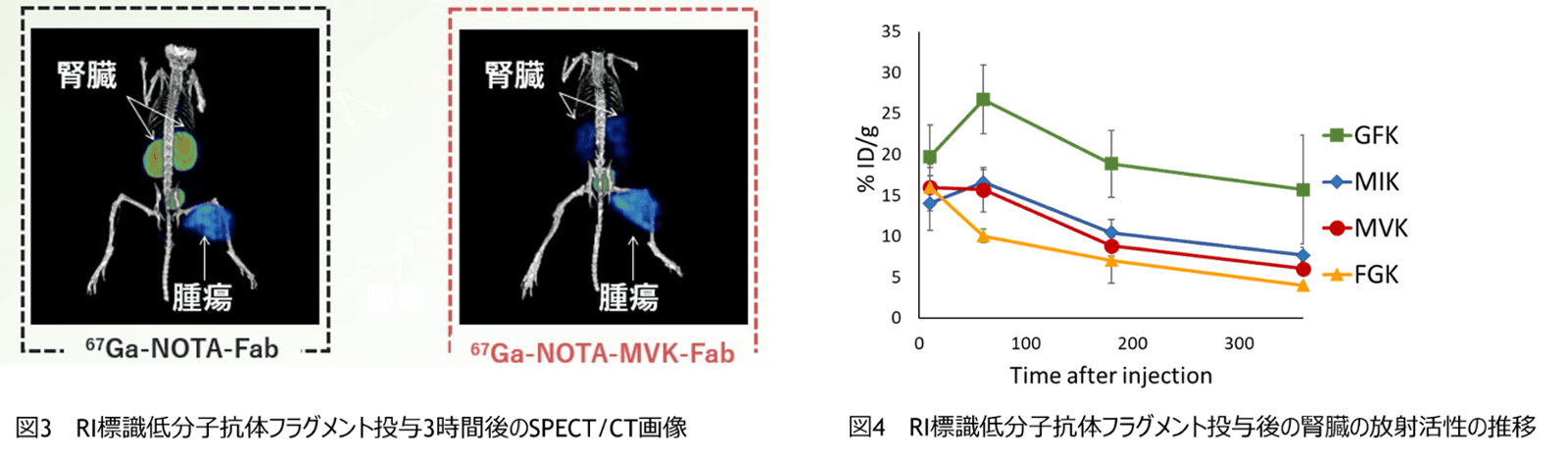
RI標識低分子ペプチドは糸球体でろ過されたのちに、近位尿細管細胞内に取り込まれ、リソソーム内でペプチドフラグメントは分解される。一方でRI標識部位を含む放射性代謝物は滞留し、尿中への排出もされにくい(図1)。本発明者らは近位尿細管細胞の細胞膜上にある腎刷子縁膜酵素に着目し、腎細胞内に再吸収される前にRI標識分子が酵素で切断され尿として排出されるような分子設計を着想した。NOTAでキレートしたRI標識分子(67Ga-NOTA)と低分子抗体のFabフラグメントの間に腎刷子縁膜酵素の切断配列であるMVK(Met-Val-Lys)を配置したRI標識低分子抗体(67Ga-NOTA-MVK-Fab)を作製した(図2)。マウスでの投与試験の結果、67Ga-NOTA-MVK-FabのRI標識分子部分(67Ga-NOTA-Met)は腎刷子縁膜酵素に切断され、腎細胞に再吸収されることなく尿として排出させることを確認した。さらに、腎臓に近い場所にある癌組織を明確に画像化することも可能であった(図3)。さらに、発明者らはいくつかの酵素認識配列を試し、その中でマウスの腎臓における蓄積がさらに改善したFGK(Phe-Gly-Lys)配列を見出し、67Ga-NOTA-FGK-Fabも作出した(図4)。
Data
- RI標識低分子抗体をマウスに投与しSPECT/CT画像で確認したところ、67Ga-NOTA-Fabを投与したマウスでは3時間後に腫瘍および腎臓でのRIシグナルが確認されたが(図3写真左)、67Ga-NOTA-MVK-Fabを投与したマウスではRIシグナルは腫瘍のみで腎集積は認められなかった(図3写真右)。
- 67Ga-NOTA-MVK-Fab、67Ga-NOTA-FGK-Fab、67Ga-NOTA-GFK-Fab、67Ga-NOTA-MIK-Fabをそれぞれマウスに投与したところ、67Ga-NOTA-FGK-Fabを投与したマウスでは、投与後経時的に腎臓からの放射活性が低減し、投与後1時間以降、最も腎放射活性が低かった(図4)。
Expectations
本発明のライセンス導入による製品化・実用化をご検討いただける、核種や核医学療法など放射線医薬品を開発している企業様とのパートナリングを希望しています。特に銅の同位体を用いた放射性医薬品や、NOTAなどのキレート剤を開発されている企業様との共同開発を歓迎します。
Patents
- PCT/JP2017/007875
- 特許出願済み(未公開)
Researchers
上原 知也先生 (千葉大学大学院薬学研究院 教授)
以下のフォームからお問い合わせください