EphA2抗体に由来するペプチドであり、RI標識による核医学治療薬のみならず、抗がん剤やDDSキャリアとの複合化、細胞内送達ツール、診断用プローブなど、多様な用途への展開が期待される。
Advantages
- 10アミノ酸未満の短鎖ペプチドでありながら、EphA2に特異的に結合し、受容体介在性エンドサイトーシスにより細胞内に取り込まれる
- 短鎖ペプチドであるため、製造や品質管理が容易で、コスト面でも有利
- 画像診断から核医学治療までを一貫して実施するセラノスティクスにも好適
Background and Technology
EphA2は、細胞膜上に存在する受容体型チロシンキナーゼの一種であり、がんの悪性化に関与することが知られている。特に、乳がん、肺がん、食道がん、大腸がん、子宮頸がん、卵巣がん、前立腺がんなど、多くのがん種で高発現し、正常組織での発現は低いため、有望ながん治療標的として注目されている。
近年、個別化医療に対する需要の高まりを背景に、がんの標的分子に結合する化合物に対して標識する放射性元素を変えることで、診断から治療までを一貫して行う「セラノスティクス(Theranostics)」というアプローチが注目されており、国内外でその研究開発が活発化している。診断と治療に同一の化合物を用いることにより、副作用の最小化と治療効果の最適化が可能となる点が、大きな利点となる。
本発明者らのグループは、PET画像診断用プローブおよびβ線治療薬として、Zr-89およびLu-177で標識したEphA2抗体を開発した。Zr-89標識体は腫瘍組織に対して優れた集積性を示し、Lu-177標識体は顕著な腫瘍縮退効果を示したことから、EphA2を標的としたセラノスティクスは、有望な治療戦略となり得ることが確認された。(Watabe T, et al. Eur J Nucl Med Mol Imaging 2025; 52:2887–2897.)
一方、RI標識抗体薬の開発には、抗体の生物学的半減期に適合する放射性核種の選択肢が少ないこと、製造コストの高さ、品質管理の煩雑さといった課題がある。抗体を断片化することで低分子化を図る技術は、これらの課題を克服し得るものとして期待されている。
今回、EphA2抗体由来のペプチドを開発し、EphA2陽性がん細胞に対する特異的な集積性および細胞内への取り込み、さらにin vivoにおける明確な抗腫瘍効果を確認した。
Data
- ヒト骨肉腫細胞(HT1080)に[225Ac]で標識したEphA2断片化抗体(peptide-1)を添加し、培養後に腫瘍細胞内への放射能取り込み量を測定したところ、30分で最も高い取り込みが確認された。対照群であるHEK293細胞と比較すると、HT1080細胞で有意に高い取り込みが観察され、がん細胞への選択的集積が示された。
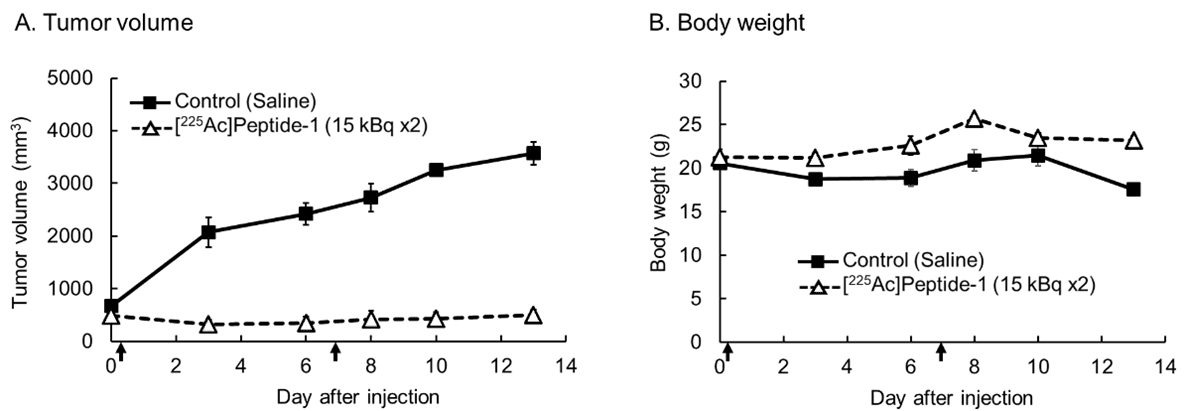
- 骨肉腫モデルマウスに[225Ac]で標識したEphA2断片化抗体(peptide-1)を2回静脈内投与したところ、腫瘍の増殖が有意に抑制され(図A)、効果は投与後2週間持続した。体重変化は対照群と比較して顕著な差が見られず(図B)、安全性の高さも示唆された。
Expectations
大阪大学では、本ペプチドを活用した診断薬・治療薬等の開発にご興味のある企業様を探しています。ご興味ございましたら、本断片化抗体のサンプル提供や評価試験も可能です。また、本発明に関し、研究者との面談による技術的な打合せも可能ですので、ご希望がございましたらお気軽にご相談ください。
Patents
特許出願中(未公開)
Researchers
白神 宜史 招へい准教授 (大阪大学 放射線科学基盤機構)
以下のフォームからお問い合わせください