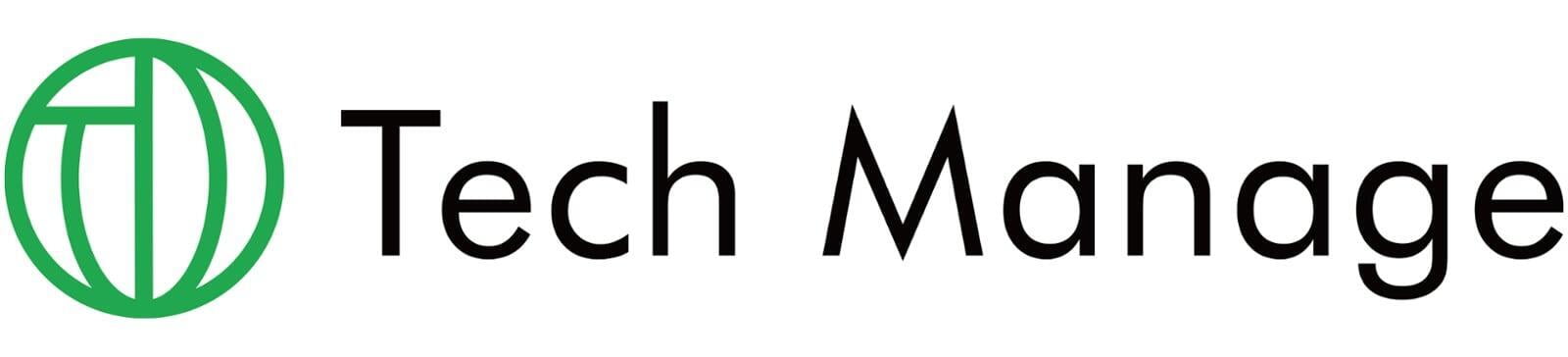ホットスポットの課題を解決する、信号強度が測定位置に依存しない構造
Advantages
- 高密度充填金ナノ粒子/TiO2薄膜/金反射膜(CP-ATA)構造を用いたSERSチップ
- 従来SERSデバイスの感度の80倍、測定ばらつきを大幅改善
- チップ基板の高再現性作製技術は熱溶融法で確立済み
- 生体内タンパク質・シトクロムcでの高感度検出実証済
Background and Technology
ラマン分光法は、ラマン散乱光を分光して得られるラマンスペクトルによって分子レベルの構造や濃度等を解析できる手法だが、この散乱光は不安定で微弱な光であるため、それを増強する技術として表面増強ラマン散乱(SERS)が開発された。SERSとは、金・銀などの貴金属ナノ構造体に吸着した分子からのラマン散乱光が何億倍にも増強される現象である。しかしながら、SERSによる検出は、金属ナノ粒子の集合体や構造に依存するため再現性の低さや、基板上に電場増強を起こすホットスポットとそれ以外の箇所によるばらつきが課題であった。
新たな構造によって構築される本ラマンチップは、高密度充填された金ナノ粒子/TiO2薄膜/金反射膜(CP-ATA)からなる強結合チップ構造である。本ラマンチップは、励起光を照射されたときに局在表面プラズモン共鳴を発生させ、かつ光反射層(金反射膜)および誘電体層(TiO2薄膜)は、励起光を照射されたときにファブリ・ペローナノ共振器として機能し、これにより、ラマン信号強度が下記図右のように励起位置に依存せず、空間的に均一な分布で計測され、再現性・定量性の高いSERSスペクトルが計測可能となる。尚、本技術のポイントとなる高密度充填する金ナノ粒子は、サイズがある程度揃っていれば、形状にバラツキがあっても高い定量性が得られることが、溶融法を用いて金ナノ粒子を作製した強結合チップで確認されている。
研究室では、金ナノ粒子に非特異的に吸着したシトクロムc (10-6 mol/L) を計測しており、今後、様々な生体分子・ウイルス・細胞を特異的に認識する化学修飾を行い、これらのさらなる高感度検出方法を確立していく計画である
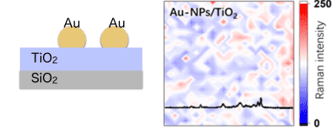
前世代ATチップ構造
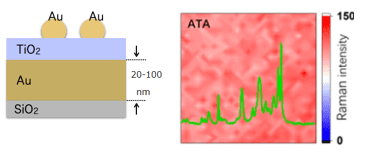
本CP-ATAチップ構造
Data
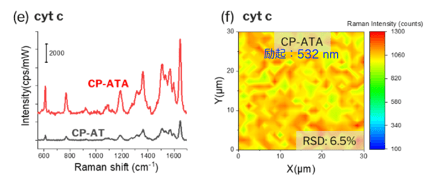
シトクロムc(cyt c)10-6 mol/Lの水溶液にCP-ATAを24時間浸漬し、乾燥後にSERSスペクトルを測定した結果
Expectations
現段階:ウイルス、生体分子での検出感度実証が完了した段階。
次段階:
①検出対象に合わせた抗体などによる表面修飾と特異性検出評価実証
②キット開発(感度・特異性、安定性、検体処理方法、プロトコル・試薬確定)
③臨床開発
上記①②③の実用化または開発コラボレーションに関心のある協働パートナーを募集しています。
先ずは、技術の詳細説明とディスカッションから、スタートさせていただければ幸いです。
Publications
Patents
- 特開2022-55689 ラマン分光測定装置、ラマン分光測定方法および表面増強ラマン散乱デバイス
- WO/2019/131640 光吸収デバイスおよびその製造方法ならびに光電極
Researchers
国立大学法人北海道大学 電子科学研究所 教授 三澤 弘明
以下のフォームからお問い合わせください