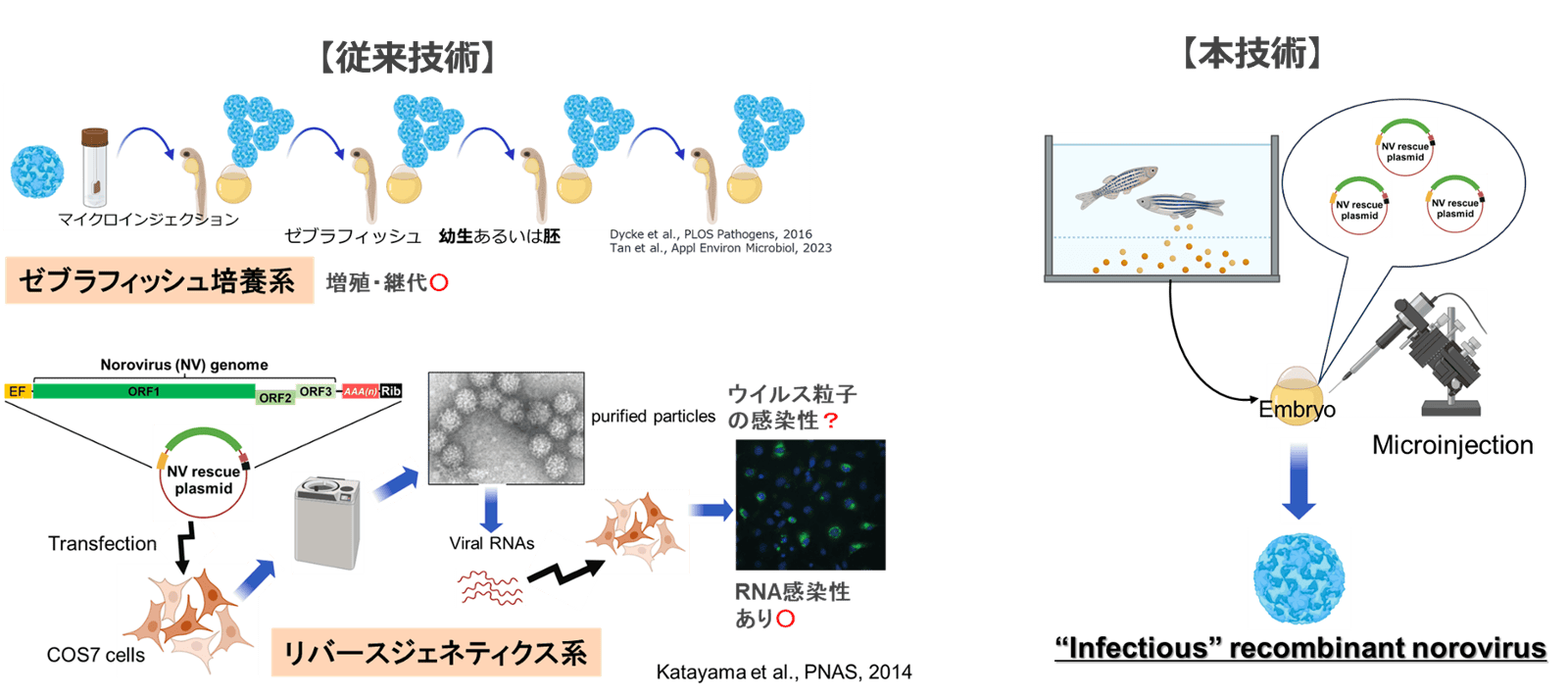
従来の培養細胞では不可能だった感染性を有する組換えヒトノロウイルスを、ゲノムcDNAプラスミドからゼブラフィッシュの胚/幼生に直接導入して作製・培養する、世界初の画期的なリバースジェネティクス技術
Advantages
- 全世界で蔓延するGII.4, GII.17など、複数の遺伝子型(Genotype)に汎用的に適用可能
- 任意の変異・欠損や、レポーター遺伝子など外来遺伝子を挿入したウイルス作製が可能
- 細胞培養プロセスが不要な「DNA直接導入法」により、工程が簡略化され、開発コストとリードタイムを大幅に削減
Background and Technology
ノロウイルスは世界で年間約6億8千万人が発症する主要な感染症だが、ワクチンや治療薬の開発は極めて困難である。この主な理由として、ヒトノロウイルスが通常の培養細胞で増殖しないことがあげられる。現在、腸管オルガノイドを用いたウイルス増殖系が研究の主流となっているが、増殖効率が低く、長期間にわたる安定した継代培養も難しいという課題がある。また、ウイルス研究に不可欠な「リバースジェネティクス(RG)技術」の研究も報告されてはいるが、作製された粒子は感染性が確認されておらず、実用性に乏しいため広く使われていない。
本技術では、既存の培養細胞RG系と、ヒトノロウイルスの継代培養が可能なゼブラフィッシュの増殖系を組み合わせ、ゲノムcDNAプラスミドをゼブラフィッシュ胚に直接導入することで、世界初のリバースジェネティクスを実現した(下図)。GII.17, GII.4などの複数の遺伝子型に対応し、野生型と同等の増殖性を保ちながら、特定核酸部位変異やレポーター遺伝子の導入を行うことができる。これにより、不安定な天然株や高価なオルガノイド培養に依存しない、簡易な安定供給が可能となり、ワクチン候補株の選定や抗ウイルス薬の評価系構築など、ノロウイルス研究開発を根本から加速させることができる。
Data
- ノロウイルスゲノムcDNAプラスミドを、ゼブラフィッシュの胚/幼生に直接マイクロインジェクションで導入したところ、感染性を有する組換えノロウイルス(GII.17, rGII.17,rGII.4)が作製され増殖した。
- 組換えノロウイルスを、ゼブラフィッシュの胚/幼生で連続して3回継代(接種)したところ、毎回3桁以上増幅し、野生型(WT)と同等の高い増殖性を維持していた。
- ノロウイルスゲノム内の特定の領域に、EcoRI認識配列変異や、レポーターとしてHiBiT tag(11アミノ酸)をコードする配列を組み込んだところ、増殖性や感染性を維持したまま増幅・継代できた。
Current Stage and Next Steps
- 感染性を有する組換えノロウイルスの作製・安定継代、およびレポーター遺伝子導入の基盤技術が確立済
- ワクチン開発に向けて弱毒株の設計、およびマウス・マーモセットなどの動物感染モデルでの応用研究(前臨床の初期段階)を実施中
Patent & Publication
Expectations
大阪大学では、本技術を活用したワクチン/抗ウイルス薬開発に興味のある製薬企業、CROを探しています。
製造方法ライセンス(社内利用/受託サービス向け)、大学にてウイルス作製受託(MTA)・変異株作成(共同研究)が可能です。
研究者と直接ご面談していただくことも可能です。
Researchers
大阪大学微生物病研究所 小林 剛 教授
以下のフォームからお問い合わせください