Advantages
- 血液脳関門(BBB)の機能を担う血管内皮細胞間のCLDN5を介する接着を、一時的に緩め薬剤の脳内送達を促進するCLDN5結合分子(低分子化合物)。
- 細胞間の接着を部分的に弱めることでBBB透過性を高める作用機序で、低・中分子を脳内送達する。
- BBBを短時間だけ開口する技術のため、BBBが長時間開口するリスクがない。
- 脳内送達技術の開発にご興味のある企業様、脳内送達させたい薬剤をお持ちの企業様とのコラボレーションを期待します。
Background and Technology
脳血管は他臓器の血管に比べてその透過性が極めて低く保たれている。この機能は血液脳関門(Brain Blood Barrier: BBB)と呼ばれ、脳を異物侵入から守る重要な役割を担っている。その一方で、BBBは血液中の薬剤の脳への送達も妨げてしまうため、脳疾患治療薬開発の大きな妨げとなっている。このBBBの機能は、脳毛細血管内皮細胞間に形成される高度な密着結合により生み出されており、この密着結合形成にはクラウディン(CLDN)ファミリーが重要な役割を担う。中でもCLDN5がBBB機能を担うことが明らかになっている。
本研究者はBBBにおけるCLDN5の働きに着目し、CLDN5に結合して血管内皮細胞間のCLDN5同士の接着を一過的に緩め、低中分子を細胞間に透過させる低分子化合物を見出した。本分子は、この活性を介して、脳内への薬物送達を促進する。また、化合物のCLDN5への結合は一過性であり、可逆的な透過制御のためBBBが長時間開口するリスクも少ない。本技術は低中分子製剤の脳内送達に貢献すると期待される。
Data
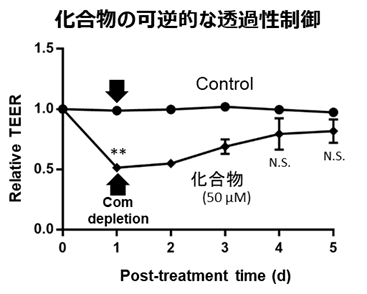
- ヒト微少血管内皮細胞を用いて化合物とフルオレセンナトリウム(蛍光色素)の透過実験を行った。化合物とフルオレセンナトリウムを細胞に添加した後、時間経過に伴う相対TEERの変化を調べたところ、添加後一時間で相対TEER値が下がり透過性が上昇したが、その後TEER値は回復し、作用が可逆的であることを確認した(右図)。
- マウスに化合物を尾静脈投与した直後にフルオレセンナトリウムを尾静脈投与したところ、脳内移行が確認されたが、化合物投与の1時間後にフルオレセンナトリウムを尾静脈投与した場合には、脳内移行は確認されなかった(下図)。

Expectations
現在、本研究室では化合物の誘導体を用いて透過性活性の向上の研究を進めています。本技術を脳内送達DDSとして一緒に開発してくださる企業様、また、脳内に送達させたい薬剤をお持ちで本技術を使って検証されたい企業様を探しています。研究者との直接のご面談によるお打合せも可能です。また、大阪大学との秘密保持契約締結による未公開データ等の開示についてご検討いただくことも可能ですので、お気軽にお尋ねください。
Patents
特許出願中(未公開)
Researchers
岡田 欣晃 准教授 (大阪大学大学院 薬学研究科)
以下のフォームからお問い合わせください