アルツハイマー病や2型糖尿病に関与するIAPP・アミロイドβの凝集抑制に関与するBRI2/BRI3のユビキチン化経路を標的とした化合物探索
Background and Technology
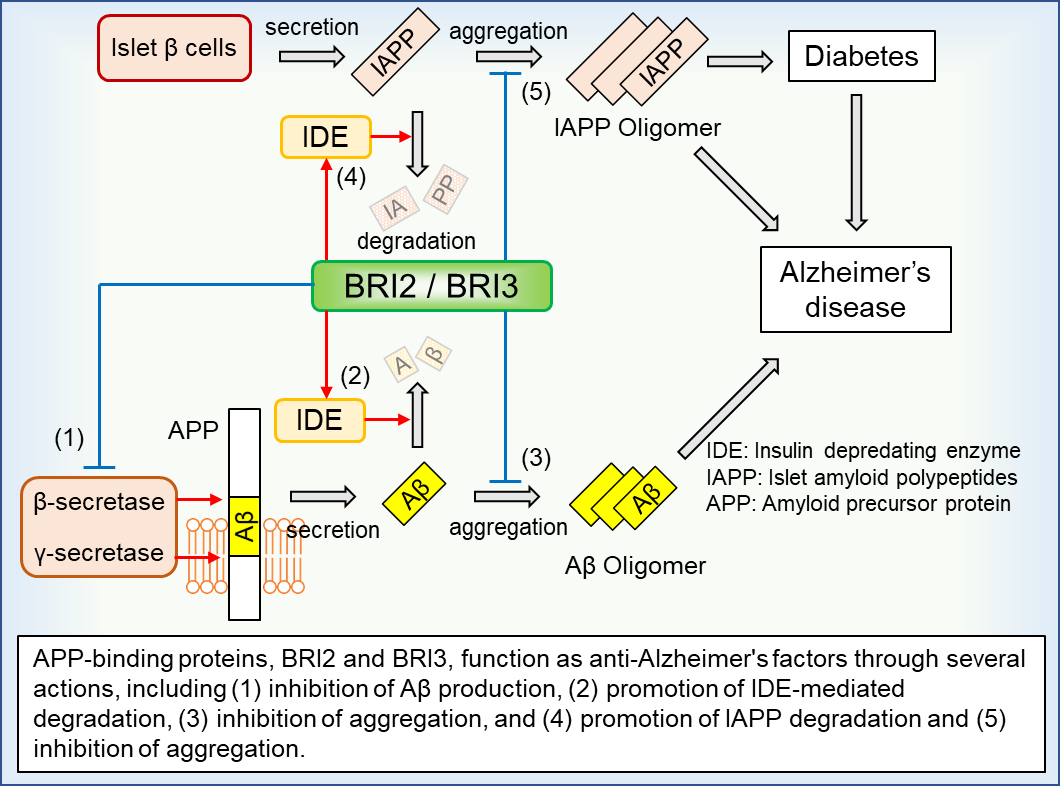
RI2/BRI3はアミロイド前駆体タンパク質(APP)に結合する分子であり、アミロイドβ(Aβ)の分解促進や凝集・蓄積を抑制することが知られている。
AβはAPP Bβ/γ-セクレターゼにより切断されることで分泌されるが、BRI2/BRI3はAPPに結合することでセクレターゼによるAβの分泌を抑制する。
また、全身性に発現するBRI2は2型糖尿病患者にみられるアミロイド沈着の主要成分である膵島アミロイドポリペプチドIAPPの凝集抑制にも関与している。
実際にBRI2の遺伝子変異がイギリス家族型認知症やデンマーク家族型認知症の原因となることから、BRI2/BRI3の機能低下とアミロイドーシスの発症が関連付けられている。
BRI2/BRI3の機能活性化はアルツハイマー病治療の新しい標的となることが期待されるが、その細胞内制御メカニズムについては不明であった。
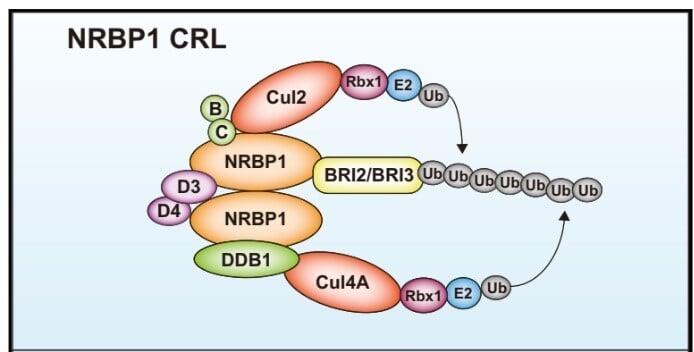
発明者らはBRI2及びBRI3分解機構としてNRBP1を介するユビキチンプロテアソーム系が関与することを初めて明らかにした。
NRBP1とBRI2の結合阻害をコンセプトとするアミロイドーシス治療薬のHTS系を構築し、初期スクリーニングでのヒット化合物がアミロイドβの産生や凝集を阻害することを明らかにした。
一方で、このヒット化合物の毒性など性質的に十分ではないことから、発明者らはさらなるスクリーニングを実施してヒット化合物を得たいと考えている。
Data
- HTSで得られたヒット化合物の添加により、内因性BRI2の発現量が増加し、BRI2のユビキチン化が抑制されることがウェスタンブロットで確認された。
- また、この化合物の添加により、Aβ40およびAβ42の発現量はDMSOに対して減少した。
Expectations
アミロイドβの分解促進や凝集抑制因子であるBRI2/BRI3のNRBP1を介する分解経路を解明
NRBP1とBRI2/BRI3との結合阻害分子のハイスループットスクリーニング(HTS)系を構築
化合物ライブラリを有する企業との協業によってヒット化合物を取得したい。
Publications
Yasukawa et al., 2020, Cell Reports 30, 3478–3491号
Patents
特開2020-183905
Yasukawa et al., 2020, Cell Reports 30, 3478–3491号
Researchers
麻生 悌二朗 先生、安川 孝史 先生(高知大学 医学部医学科 遺伝子機能解析学)
以下のフォームからお問い合わせください
